Carfilzomib und Daratumumab beim Multiplen Myelom
Carfilzomib
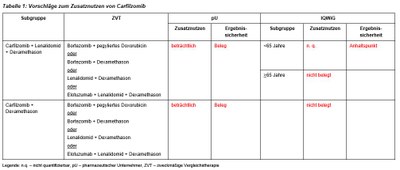
Dieses Verfahren zur frühen Nutzenbewertung zu Carfilzomib (Kyprolis®) wird nach Überschreiten der im AMNOG festgelegten Umsatzgrenze von 50 Mio EUR für Arzneimittel im Orphan-Drug-Status durchgeführt. Carfilzomib ist zugelassen in Kombination mit Dexamethason sowie in Kombination mit Lenalidomid / Dexamethason, jeweils bei Patienten nach mindestens einer Vortherapie. Der G-BA hat das IQWiG mit dem Bericht beauftragt. Indikationen, zweckmäßige Vergleichstherapie, Vorschläge von pharmazeutischem Unternehmer und IQWiG zur Festlegung des Zusatznutzens sind in Tabelle 1 zusammengefasst.
Unsere Anmerkungen sind:
Anwendungsgebiet A Carfilzomib / Lenalidomid / Dexamethason
- Für die Beurteilung des Zusatznutzens liegen Daten von ASPIRE, einer multizentrischen, randomisierten Studie zum Vergleich der Dreifachkombination Carfilzomib/Lenalidomid/Dexamethason versus der Zweifachkombination Lenalidomid/Dexamethason vor. Gegenüber der Erstbewertung liegen belastbare Daten zur Überlebenszeit vor.
- Die Hinzunahme von Carfilzomib führt zu einer Erhöhung der Remissionsrate, der Rate tiefer Remissionen, zur Verlängerung der progressionsfreien Überlebenszeit, der Zeit bis zur Einleitung der nächsten Therapie und zu einer Verlängerung der Gesamtüberlebenszeit (Hazard Ratio 0,81; p=0,053). Es fehlen Daten zur Postprogressionstherapie.
- Der Vorschlag einer altersabhängigen Subgruppenbildung bei 65 Jahren ist medizinisch nicht begründbar. Das mittlere Erkrankungsalter von Patienten mit Multiplem Myelom in Deutschland liegt bei 73 Jahren. Prognostisch entscheidender bei diesen Patienten sind Komorbiditäten wie z. B. Niereninsuffizienz.
- Die Nebenwirkungsrate im Carfilzomib-Arm war nicht wesentlich höher als im Kontrollarm, häufigste zusätzliche Nebenwirkung im CTCAE Grad 3/4 war eine Hypokaliämie.
- Die Daten zur Lebensqualität sind nicht vollständig.
Anwendungsgebiet B Carfilzomib / Dexamethason
- Für die Beurteilung des Zusatznutzens liegen Daten von ENDEAVOR, einer multizentrischen, randomisierten Studie zum Vergleich der Kombination Carfilzomib/Dexamethason versus Bortezomib/Dexamethason nach Vortherapie mit mindestens mit einem der wirksamen Arzneimittel Bortezomib, Lenalidomid oder Thalidomid vor. Diese Studie erfüllt die Forderung nach direkten Vergleichen (Kopf an Kopf, Head to Head) zwischen neuem Arzneimittel und bisherigem Standard. Der Standardarm mit Bortezomib/Dexamethason entspricht dem aktuellen wissenschaftlichen und klinischen Standard.
- Carfilzomib führt gegenüber Bortezomib zu einer Erhöhung der Remissionsrate, der Rate tiefer Remissionen, zur Verlängerung der progressionsfreien Überlebenszeit, der Zeit bis zur Einleitung der nächsten Therapie und zu einer Verlängerung der Gesamtüberlebenszeit.
- Die Rate peripherer Neuropathien im CTCAE Grad >2 lag im Carfilzomib- gegenüber dem Bortezomib-Arm mit 6 vs 32% deutlich niedriger.
Die Dreifachtherapie mit Hinzunahme von Carfilzomb ist eine hoch wirksame Behandlungsoption bei Patienten mit rezidiviertem Multiplen Myelom. Für die Etablierung eines neuen Therapiestandards sind vergleichende Studien mit den anderen, neu zugelassenen Arzneimitteln erforderlich.
Bei Patienten mit Indikation zu einer Proteasom-Inhibitor-Therapie nach Vortherapie mit Bortezomib, Lenalidomid und/oder Thalidomid ist Carfilzomib wirksamer und besser verträglich als Bortezomib (Anwendungsgebiet B).
Daratumumab
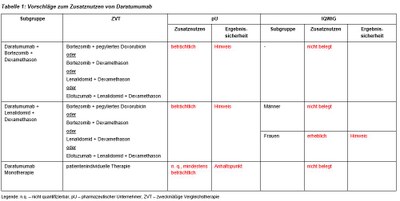
Dieses Verfahren zur frühen Nutzenbewertung von Daratumumab (Darzalex®) kombiniert die Neubewertung der Daratumumab-Monotherapie nach nach Überschreiten der im AMNOG festgelegten Umsatzgrenze von 50 Mio EUR für Arzneimittel im Orphan-Drug-Status durchgeführt und die Nutzenbewertung der neuen Kombinationstherapien. Daratumumab ist als Monotherapie zugelassen für Patienten im Rezidiv oder bei Refraktarität gegenüber Proteasom-Inhibitoren und gegenüber immunmodulatorischen Substanzen. In Kombination mit Dexamethason und Bortezomib oder Lenalidomid ist Daratumumab zugelassen bei vorbehandelten Patienten. Der G-BA hat das IQWiG mit dem Bericht beauftragt. Indikationen, zweckmäßige Vergleichstherapie, Vorschläge von pharmazeutischem Unternehmer und IQWiG zur Festlegung des Zusatznutzens sind in Tabelle 1 zusammengefasst.
Unsere Anmerkungen sind:
- Für die Nutzenbewertung der Daratumumab-Kombinationstherapie liegen Daten von zwei multizentrischen, randomisierten Phase III-Studien zur Kombination von Daratumumab mit Bortezomib/Dexamethason (CASTOR-Studie) bzw. Lenalidomid/Dexamethason (POLLUX-Studie) vor. Beide Studien sind vollumfänglich als Basis der frühen Nutzenbewertung geeignet.
- In beiden Kombinationstherapien führt Daratumumab zu einer Steigerung der Remissionsrate, der Rate tiefer Remissionen, der progressionsfreien Überlebenszeit und der Gesamtüberlebenszeit. Der Einfluss auf die Gesamtüberlebenszeit ist bemerkenswert angesichts der Vielfalt von heute zugänglichen Postprogressionstherapien.
- Die Lebensqualität ist in den Daratumumab- und in den Kontrollarmen etwa gleich.
- Die Nutzenbewertung zur Daratumumab-Monotherapie basiert auf Phase I/II-Studien.
- Mangels direkt vergleichender Studiendaten ist der Zusatznutzen der Monotherapie nicht zuverlässig beurteilbar.
- Die Nebenwirkungen im CTCAE Grad 3/4 betreffen vor allem das Blutbild.
Die Anti-CD38-Therapie mit Daratumumab ist eine wirksame Erweiterung der Therapie von Patienten mit Multiplem Myelom. Die Daten zur Verlängerung des progressionsfreien Überlebens mit einem Hazard Ratio zwischen 0,3 und 0,4 und der Gesamtüberlebenszeit in beiden randomisierten Studien sind beeindruckend. Sie sprechen auch dafür, Daratumumab frühzeitig und nicht als letzte Therapieoption einzusetzen.
