Emicizumab bei Hemmkörper-Hämophilie
Die Frühe Nutzenbewertung von Emicizumab (Hemlibra®) ist das fünfte Verfahren zur frühen Nutzenbewertung eines neuen Arzneimittels für die Therapie und Prophylaxe bei Patienten mit Hämophilie A, das erste für Patienten mit Hämophilie A und Faktor-VIII(FVIII)-Hemmkörpern. Emicizumab ist zugelassen zur Prävention oder zur Reduktion von Blutungen bei Patienten mit Hämophilie A, die inhibitorische Faktor VIII-Antikörper entwickelt haben und damit nicht effektiv mit Faktor VIII-Gerinnungsfaktorenkonzentraten behandelt werden können.
Der G-BA hat als zweckmäßige Vergleichstherapie entweder rekombinante oder aus humanem Plasma gewonnene FVIII-Präparate in höherer Dosis festgelegt, alternativ FVIII-Präparate mit Bypassing-Aktivität. Der G-BA hat das IQWiG mit dem Bericht beauftragt.
Indikationen, zweckmäßige Vergleichstherapie, Vorschläge von pharmazeutischem Unternehmer und IQWiG zur Festlegung des Zusatznutzens sind in Tabelle 1 zusammengefasst.
Tabelle 1: Vorschläge zum Zusatznutzen von Emicizumab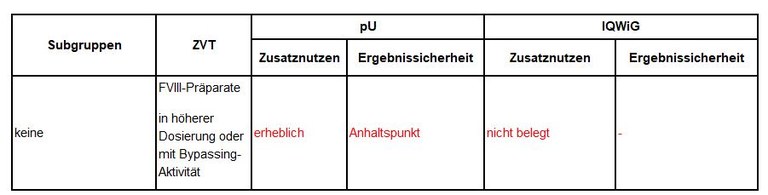
Legende: pU – pharmazeutischer Unternehmer, ZVT – zweckmäßige Vergleichstherapie
Unsere Anmerkungen sind:
- Emicizumab gehört zu einer neuen Substanzklasse von Arzneimittel zur Prophylaxe von Blutungen bei Patienten mit angeborener Hämophilie A, die einen Inhibitor gegen Faktor VIII entwickelt haben.
- Zweckmäßige Vergleichstherapie ist eine Prophylaxe mit FVIII-Bypass-Produkten. Diese ist allerdings wenig effektiv und für die Patienten aufwändig.
- Emicizumab führt in einer randomisierten Studie mit 53 Patienten (2:1 Randomisierung) gegenüber einem Kontrollarm ohne Prophylaxe zu einer Senkung der annualisierten Blutungsrate. Die erzielten Ergebnisse sind denen aus Kohorten nicht-randomisierter Patienten vergleichbar.
- Die Nebenwirkungsrate ist niedrig.
- Vorteile von Emicizumab liegen in der subkutanen Gabe und in einer Verbesserung der Compliance.
Die Anforderungen der Zulassungsbehörden unterscheiden sich bei Gerinnungspräparaten erheblich von der Methodik der Nutzenbewertung. Alle bisher eingereichten Dossiers zu neuen FVIII-Präparaten waren unvollständig für eine Nutzenbewertung. Dies trifft auch auf Emicizumab zu. Erforderlich sind Daten einer randomisierten Studie im Vergleich zu einer Prophylaxe nach dem Versorgungsstandard.