Durvalumab beim NSCLC Stadium III
26.02.2019
Die frühe Nutzenbewertung von Durvalumab ist ein weiteres Verfahren zur Immuntherapie des nichtkleinzelligen Lungenkarzinoms (NSCLC), das erste Verfahren zu Patienten im Stadium III.
Durvalumab ist zugelassen als Monotherapie bei Patienten mit lokal fortgeschrittenem und inoperablem NSCLC, die nach kombinierter Radiochemotherapie nicht progredient sind. Voraussetzung für den Einsatz von Durvalumab ist der Nachweis einer PD-L1-Expression (Tumor Progression Score (TPS) von >1% der Tumorzellen. Der G-BA hat keine Subgruppen gebildet und das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1. 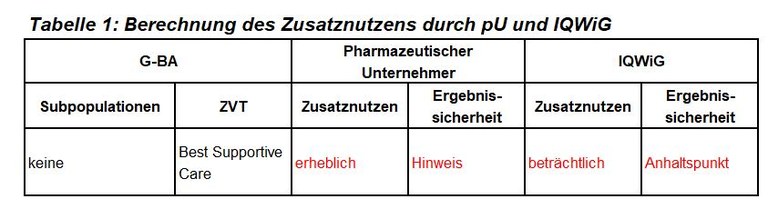
Unsere Anmerkungen sind:
- Basis der frühen Nutzenbewertung ist PACIFIC, eine internationale, multizentrische, Placebo-kontrollierte Phase-III-Studie, zum Vergleich von Durvalumab vs Best Supportive Care mit 713 Patienten. Basis der frühen Nutzenbewertung ist die Gruppe der 303 Patienten mit einer PD-L1-Expression >1%. Die zweckmäßige Vergleichstherapie entspricht den Empfehlungen der Fachgesellschaften.
- Durvalumab führt gegenüber Placebo zur signifikanten Verlängerung der progressionsfreien Überlebenszeit (Median 18,3 Monate; HR 0,44), der Gesamtüberlebenszeit (Median nicht erreicht; HR 0,54) und der Überlebensrate nach 2 Jahren um 19,2 %. Leider fehlen Daten zur Postprogressionstherapie.
- Die Rate schwerer unerwünschter Ereignisse im CTCAE Grad 3/4 war in der Gesamtstudie im Durvalumab- nicht höher als im Kontroll-Arm. Immunvermittelte Reaktionen aller Schweregrade traten bei 24,2% der Patienten im Durvalumab- und bei 8,1% der Patienten im Placebo-Arm auf.
- Das Dossier hat einige Defizite, zum einen durch Design und Durchführung der PACIFIC-Studie, zum anderen durch den Zulassungsprozess der EMA bedingt. Relevant sind:
- Das Stadium III ist sehr heterogen, es fehlt eine differenzierte Aufschlüsselung. Das Staging entspricht nicht vollständig dem deutschen Leitlinienstandard, die durchzuführenden Untersuchungen vor Therapie und zur Definition der Progression nach Radiochemotherapie waren im Studienprotokoll nicht vorgegeben. Möglicherweise ist der Anteil von Patienten im Stadium IV höher als angegeben.
- Etwa ein Viertel der Patienten erhielt zusätzlich eine Induktionschemotherapie.
- Eine Bestimmung der PD-L1-Expression wurde nur bei 63,3% der Patienten und nur an Biopsien vor Beginn der Strahlenchemotherapie durchgeführt, nicht zu Beginn der Durvalumab-Gabe. Die zulassungsrelevante Analyse von Patienten mit einer PD-L1-Expression >1% ist eine Post-Hoc-Analyse. Die Verteilung von Patienten mit einer Expression von PD-L1 >25% ist ungleich zwischen den Studienarmen. Möglicherweise profitieren auch Patienten mit einer Expression von PD-L1 <1% von Durvalumab.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Durvalumab den Grad 4 (Skala 1 (niedrig) – 5 (hoch)).
Durvalumab gehört jetzt zur Standardtherapie bei Patienten mit inoperablem NSCLC im Stadium III nach definitiver Radiochemotherapie.
Zur Stellungnahme
