Niraparib beim Ovarialkarzinom
Niraparib (Zejula®) ist einer von drei zugelassenen PARP-Inhibitoren beim fortgeschrittenem Ovarialkarzinom. Niraparib ist zugelassen für die Erhaltungstherapie bei rezidivierten Patientinnen mit gering differenziertem, serösem Karzinom der Ovarien, der Tuben oder mit primärer Peritonealkarzinose, die erneut auf eine platinhaltige Chemotherapie angesprochen haben, d. h. eine komplette oder partielle Remission erreicht haben. Die erste frühe Nutzenbewertung von Niraparib war im Rahmen seines Status als Medikament zur Behandlung einer seltenen Erkrankung (Orphan Drug) durchgeführt worden. Der G-BA hatte damals einen nicht quantifizierbaren Zusatznutzen festgestellt, aber darauf hingewiesen, dass er „das Ausmaß des allein aus rechtlicher Sicht … zu unterstellenden Zusatznutzens … derzeit als nicht quantifizierbar einstuft.“ Der Umsatz von Niraparib hat inzwischen die im AMNOG festgelegte Umsatzgrenze von 50 Mio. Euro überschritten, so dass ein erneutes Verfahren eingeleitet werden musste. Der G-BA hat das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
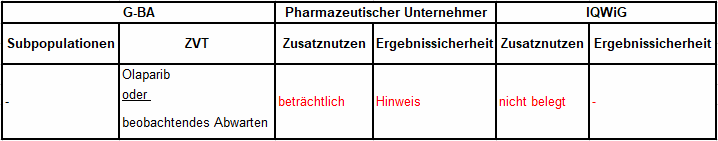
Unsere Anmerkungen sind:
- ZVT bei behandlungsfähigen Patientinnen ist Olaparib.
- Basis der frühen Nutzenbewertung ist NOVA, eine internationale, randomisierte, Placebo-kontrollierte Studie mit einer 2:1 Randomisierung zugunsten des Niraparib-Arms.
- Die Daten aus der ersten Nutzenbewertung haben sich bestätigt, dazu sind Daten zur Therapiesicherheit gekommen. Niraparib führt sowohl bei Patientinnen mit als auch ohne BRCA1/2-Mutationen zu einer deutlichen Verlängerung des progressionsfreien Überlebens mit einem Hazard Ratio von 0,27 bzw. 0,45.
- Niraparib führt in der bisherigen Auswertung nicht zur Verlängerung der Gesamtüberlebenszeit, der Median der Gesamtüberlebenszeit wurde in beiden Studienarmen bisher nicht erreicht.
- Niraparib führt zu einer deutlichen Verlängerung der TWiST (Time without Toxicity and Symptoms). Das ist vor allem in der Rezidivsituation sehr patientenrelevant.
- Die Rate schwerer Nebenwirkungen liegt bei 74,1%, die Rate von Therapieabbrüchen aufgrund von Nebenwirkungen bei 14,7%. Die Mehrzahl schwerer Nebenwirkungen von Niraparib ist hämatologisch, ohne klinische Symptomatik und therapeutische Konsequenz, auch bei älteren Patientinnen (>70 Jahre).
Mit Niraparib, Olaparib und Rucaparib sind jetzt drei wirksame PARP-Inhibitoren zur Erhaltungstherapie von Patientinnen mit rezidiviertem, epithelialem Ovarialkarzinom, die erneut auf eine platinhaltige Chemotherapie angesprochen haben, zugelassen. Die Wirksamkeit erscheint insgesamt vergleichbar.
