Cemiplimab beim Basalzellkarzinom der Haut
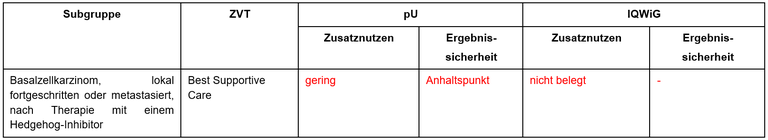
Cemiplimab ist indiziert für die Behandlung von erwachsenen Patient*innen mit lokal fortgeschrittenem oder metastasiertem Basalzellkarzinom (locally advanced basal cell carcinoma, laBCC, oder metastatic basal cell carcinoma, mBCC), bei denen eine Krankheitsprogression unter einem Hedgehog-Signalweg-Inhibitor (hedgehog pathway inhibitor, HHI) aufgetreten ist oder die eine Unverträglichkeit gegen einen HHI haben. Der G-BA hat das IQWiG mit der Dossierbewertung beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1. Vorschläge von pharmazeutischem Unternehmer und IQWiG zur Festlegung des Zusatznutzens sind in Tabelle 1 zusammengefasst.
Tabelle 1: Vorschläge zum Zusatznutzen von Vismodegib
Unsere Anmerkungen sind:
- Standard der Therapie bei Patient*innen mit lokal fortgeschrittenem oder metastasiertem Basalzellkarzinom der Haut nach Vortherapie mit einem Hedgehog-Inhibitor ist Best Supportive Care.
- Basis der frühen Nutzenbewertung von Cemiplimab ist eine einarmige Studie mit Einschluss von zwei Gruppen von Patient*innen im Dossier des pharmazeutischen Unternehmers:
- lokal fortgeschritten n = 84 (ausgewertet im Dossier)
- metastasiert n = 28 (ausgewertet im Dossier)
- Unter Cemiplimab erreichten 26,8% der Patient*innen eine Remission, die progressionsfreie Überlebenszeit lag bei 13,1 Monaten, die Überlebensrate nach 2 Jahren bei 78%.
- Im intraindividuellen Vergleich der Lebensqualität zeigten sich Verbesserungen vor allem in der sozialen Funktion und bei der Schmerzsymptomatik.
- Die Nebenwirkungen waren substanzklassenspezifisch für Immuncheckpoint-Inhibitoren.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Cemiplimab den Grad 3 (Skala 1 (niedrig) – 5 (hoch)).
Cemiplimab ist eine wertvolle Option für Patient*innen mit lokal fortgeschrittenem oder metastasiertem Basalzellkarzinom nach Vortherapie mit einem Hedgehog-Inhibitor. Eine belastbare Bestimmung des Zusatznutzens ist aufgrund des Fehlens randomisierter Studien nicht möglich. Die Zahl der pro Jahr in Deutschland für die Cemiplimab-Therapie geeigneten Patient*innen ist klein und liegt im Bereich von seltenen Erkrankungen.
