Amivantamab beim NSCLC mit Nachweis einer EGFR-Exon-20-Insertionsmutation
Amivantamab ist zugelassen zur Behandlung von Patient*innen mit fortgeschrittenem, nichtkleinzelligem Lungenkarzinom (non small cell lung cancer, NSCLC) und aktivierenden Exon 20-Insertionsmutationen des epidermalen Wachstumsfaktor-Rezeptors (EGFR) nach Versagen einer platinbasierten Therapie. Das IQWiG wurde vom G-BA mit dem Bericht beauftragt. Subgruppen, zweckmäßige Vergleichstherapie sowie Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
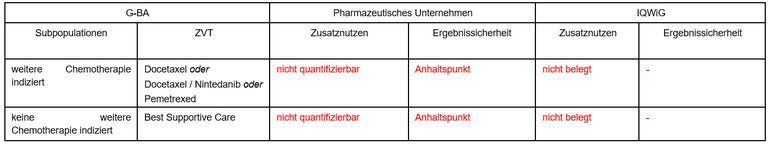
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Bisheriger Standard war eine Therapie nach Maßgabe der behandelnden Ärzt*innen unter Berücksichtigung der Vortherapie, des Allgemeinzustandes und der Komorbiditäten. Die Auflistung der zweckmäßigen Vergleichstherapie ist unvollständig und umfasst nicht alle, derzeit in dieser Indikation zugelassenen und eingesetzten Arzneimittel.
- Die Bildung von Subgruppen in einer kleinen Patientenpopulation ist nicht zielführend. Die geschätzte Zahl von Patient*innen in der zweiten Subgruppe liegt bei 2 (1-4) pro Jahr.
- Basis der frühen Nutzenbewertung ist CHRYSALIS, eine offene, internationale, multizentrische Phase-I- Studie.
- Amivantamab führte bei über 36,8% der Patient*innen zu einer Remission. Die mediane progressionsfreie Überlebenszeit lag bei 6,7 Monaten, die mediane Gesamtüberlebenszeit bei 22,8 Monaten. Im indirekten Vergleich mit deutschen Registerdaten wird die Gesamtüberlebenszeit mehr als verdoppelt.
- Amivantamab ist ein bispezifischer Antikörper, der den EGF-Rezeptor und MET inhibiert. Daraus resultieren Nebenwirkungen wie Rash und Diarrhoe, die durch die EGFR-Blockade bzw. Hypalbuminämie mit peripheren Ödemen und interstitielle Pneumonitis, durch die MET-Inhibition verursacht werden. Hämatologische Toxizitäten treten hingegen nicht in Erscheinung.
- Amivantamab ist ein bispezifischer Antikörper. Das zeigt sich im Nebenwirkungsspektrum sowohl in der EGFR-Blockade (z. B. Rash, Diarrhoe) als auch der MET-Inhibition (z. B. Hypalbuminämie mit peripheren Ödemen, interstitielle Pneumonitis)
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Amivantamab den Grad 3 (Skala 1 (niedrig) – 5 (hoch)).
Für Patient*innen mit EGFR-Exon-20-Insertionsmutationen wird Amivantamab einem bisher ungedeckten, medizinischen Bedarf gerecht. Allerdings entspricht die Zulassung „nach platinbasierter Chemotherapie“ nicht mehr vollständig dem aktuellen Versorgungsstandard der initialen Immunchemotherapie. Offen bleibt auch das Vorgehen bei Patient*innen mit Nachweis der Insertionsmutation EGFR-A763_Y764insFQEA und Vortherapie mit Osimertinib. Hier ist die Erhebung zusätzlicher Registerdateien aus der Versorgung zu diskutieren.
