Daratumumab beim Multiplen Myelom (Erstlinientherapie)
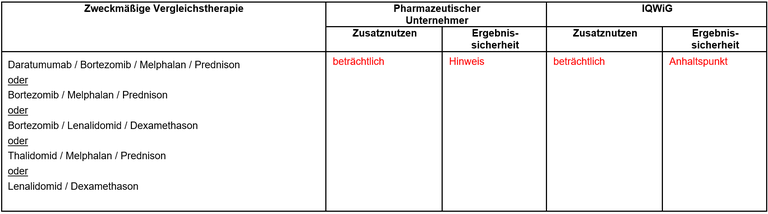
Im ersten Verfahren der frühen Nutzenbewertung (2020-02-15-D-521) zum Einsatz von Daratumumab (Darzalex®) in Kombination mit Lenalidomid / Dexamethason in der Erstlinientherapie des Multiplen Myeloms bei Patient*innen, die nicht für eine autologe Stammzelltransplantation geeignet sind, hatte der G-BA den Anhaltspunkt für einen geringen Zusatznutzen festgelegt. Daratumumab war in dieser Indikation zunächst zugelassen in Kombination mit Bortezomib, Melphalan und Prednison. Diese Zulassung wurde 2019 erweitert auf die Kombination mit Lenalidomid und Dexamethason. Das IQWiG wurde mit der Dossierbewertung beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen einheitlich zum Bewertungsvorschlag eines beträchtlichen Zusatznutzens. Zweckmäßige Vergleichstherapie sowie die Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
Tabelle 1: Vorschläge zum Zusatznutzen von Daratumumab
Unsere Anmerkungen sind:
- Zweckmäßige Vergleichstherapie ist eine Behandlung nach Maßgabe des behandelnden Arztes. Dies entspricht der Heterogenität der Patientenpopulation und der Behandlungsrealität in Deutschland. Eine Behandlung nach Maßgabe des behandelnden Arztes beinhaltet auch Lenalidomid + Dexamethason.
- Basis der frühen Nutzenbewertung ist die internationale, multizentrische, randomisierte, offene Phase-III-Studie MAIA zum Vergleich der Kombination von Daratumumab/Lenalidomid/Dexamethason gegenüber Lenalidomid/Dexamethason.
- Die Kombinationstherapie mit Daratumumab führt zu einer signifikanten Steigerung der Remissionsrate, zur Erhöhung der Rate von Patienten ohne nachweisbare minimale Resterkrankung (MRD) sowie zur Verlängerung der progressionsfreien Überlebenszeit. Das mediane progressionsfreie Überleben ist bislang im Daratumumab-Arm nicht erreicht und wird derzeit auf über 55 Monate geschätzt. Die Gesamtüberlebenszeit ist mit dem in diesem Verfahren vorgelegten 3. Datenschnitt signifikant verlängert.
- Die Rate schwerer Nebenwirkungen wird durch die Kombination mit Daratumumab insgesamt nur gering gesteigert, erhöht ist die Rate von schweren Neutropenien und von Infektionen.
- Bei den Patienten-berichteten Endpunkten zeigten sich signifikant vorteilhafte Unterschiede zugunsten des Daratumumab-Arms (je nach angewandter Methodik) beim allgemeinen Gesundheitszustand, bei gesundheitsbezogener Lebensqualität, bei Schmerzen mit schnellerer und tieferer Schmerzreduktion sowie einer Verlängerung der Zeit bis zur Wiederaufnahme einer Schmerztherapie mit Opioden, und bei Fatigue.
Die aktualisierten Daten zu Daratumumab/Lenalidomid/Dexamethason bestätigen die Rolle von Anti-CD38-Antikörpern als Standard in der Erstlinientherapie bei Patient*innen, die nicht für eine Hochdosistherapie geeignet sind.
