Valoctocogen Roxaparvovec zur Gentherapie der Hämophilie A
Valoctocogen Roxaparvovec ist zugelassen zur Therapie der schweren Hämophilie A bei erwachsenen Patienten ohne Faktor-VIII-Inhibitoren und ohne nachweisbare Antikörper gegen Adeno-assoziiertes Virus Serotyp 5 (AAV5). Der G-BA hat den Bericht selbst erstellt. Indikationen und Vorschläge des pharmazeutischen Unternehmers zur Festlegung des Zusatznutzens sind in Tabelle 1 zusammengefasst.
Tabelle 1: Vorschläge zum Zusatznutzen von Valoctocogen Roxaparvovec
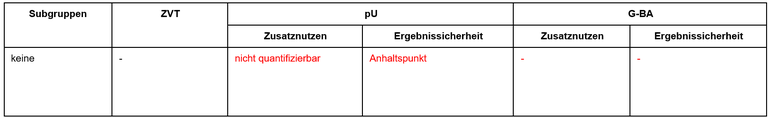
Legende: pU – pharmazeutischer Unternehmer, ZVT – zweckmäßige Vergleichstherapie
Unsere Anmerkungen sind:
- Valoctocogen Roxaparvovec ist das erste zugelassene Arzneimittel zur Gentherapie der Hämophilie A. Aufgrund des Status eines Arzneimittels für seltene Leiden wurde keine zweckmäßige Vergleichstherapie festgelegt. In der Versorgung wird der Einsatz gegenüber einer Fortsetzung der prophylaktischen und therapeutischen Gabe von FVIII-Präparaten oder Emicizumab erfolgen.
- Grundlage der Zulassung war eine nicht-randomisierte Studie mit 132 für die frühe Nutzenbewertung ausgewerteten Teilnehmern. Hierbei wurden Blutungsereignisse, Faktorspiegel, Faktorenverbrauch und Angaben zur Lebensqualität prospektiv erfasst und intraindividuell mit einem Zeitraum vor Therapie verglichen.
- Die einmalige Gabe von Valoctocogen Roxaparvovec führte zur nachhaltigen Erhöhung der FVIII-Konzentration, zur signifikanten Senkung der annualisierten Blutungsrate und zur Steigerung der Lebensqualität.
- Nebenwirkungen sind häufig und werden vor allem durch eine Reaktion der Leber auf den hepatotropen, adenoviralen Vektor verursacht. Bei 79,1% der Patienten wurden Glukokortikoide zum Nebenwirkungsmanagement eingesetzt.
- Ergebnisse der Phase-I/II-Studie (270-201) liefern Langzeitdaten (bis zu 6 Jahren) zu patientenrelevanten Endpunkten, einschließlich Blutungsergebnissen, FVIII-Werten und gesundheitsbezogener Lebensqualität.
Valoctocogen Roxaparvovec ist das erste zugelassene Arzneimittel zur Gentherapie der Hämophilie A. Aufgrund des Status eines Arzneimittels für seltene Leiden wurde keine zweckmäßige Vergleichstherapie festgelegt. In der Versorgung wird der Einsatz gegenüber einer Fortsetzung der prophylaktischen und therapeutischen Gabe von Halbwertszeit-verlängerten FVIII-Präparaten oder Emicizumab erfolgen.
